
近日,美国化学会期刊ACS Catalysis在线发表了上海交通大学生命科学技术学院、微生物代谢国家重点实验室赵一雷教授团队在硫酯酶聚酮环化机制研究上的最新进展“Theoretical Studies on the Catalytic Mechanism and Substrate Diversity for Macrocyclization of Pikromycin Thioesterase”(DIO:10.1021/acscatal.8b01156)。石婷副研究员为第一作者。
在医学临床上多种常见的抗生素、抗真菌药物、免疫抑制剂和抗癌药物均属于聚酮类化合物,它是一类微生物次生代谢产物。由于聚酮类化合物极其重要的药用价值,聚酮合酶体系(PKS)自发现以来就备受关注,研究表明,该合成酶系中硫酯酶决定了聚酮母体的释放效率及化学结构。继2016年揭示红霉素(DEBS)硫酯酶催化聚酮链环化反应的机制之后,赵一雷教授研究团队继续与白林泉教授团队合作,对苦霉素硫酯酶的底物特异性展开了深入研究。
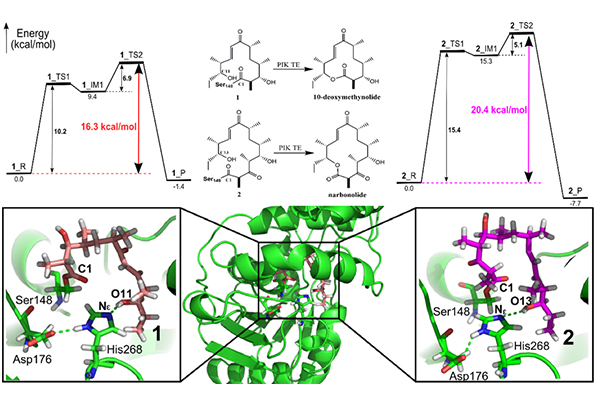
研究团队构建了苦霉素pikromycin的两种天然底物(十二元环10-deoxymethynolide(1)和十四元环narbonolide(2))所对应的研究体现(PIK-TE-1和PIK-TE-2),运用分子动力学模拟(MD)、量子力学与分子力学联用的QM/MM方法,分析了两种底物形成“预反应态(PRS,prereaction state)”的难易程度,发现PIK-TE-1体系比PIK-TE-2体系更容易形成稳定的预反应态。同时,预反应态的结构特征分析表明,氢键和疏水相互作用在底物识别和产物释放过程发挥了重要作用。此外,通过反应势能面的计算发现,PIK-TE-1体系环化过程中底物末端羟基从re面方向亲核进攻的环化反应能垒为16.3 kcal/mol,比从si面进攻的能垒要低3.6 kcal/mol,而相比于PIK-TE-2体系的re面进攻的反应能垒低4.1 kcal/mol,这与实验结果相符。
该研究结果不仅再次验证了赵一雷研究团队提出的“预反应态模型”(PRS model)在合成生物学酶分子机制研究中的广泛适用性,而且进一步加深了科学家们对硫酯酶底物特异性的理解,为蛋白质工程提供了理论基础。
文字 | 石婷

Address: 800 Dongchuan RD. Minhang District, Shanghai, China
School of Life Sciences and Biotechnology, SJTU Copyright © 2017 沪交ICP备05029. All Rights Reserved.


